|
Сероводород H2S
– газ, образуется при действии гнилостных бактерий на серусодержащие белки,
поэтому его запах ассоциируется с запахом тухлых яиц. Вдыхание чистого сероводорода
может привести к мгновенной смерти; даже
его 0,01%-ное содержание в воздухе
опасно для человека, т. к. он может накапливаться в организме, соединяясь с
железом , входящим в состав гемоглобина, образуя сульфид - FeS.
Это приводит к тяжелому кислородному голоданию и удушью. Причём окраска крови
становится чёрно-зелёной.
В H2S
угол отталкивания меньше, чем у Н2О

Сера менее электроотрицательна, чем кислород,
связь слабее поляризована.
H2S
в лаборатории получают действуя на суфиды кислотой
FeS + 2HCl → FeCl2 + H2S↑
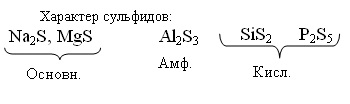
Различно
реагируют с Н2О
Основн.
Na2S + H2O → NaHS + NaOH (гидролиз)
Амф. Al2S3 + 6H2O → Al(OH)3 + H2S↑
Кисл.SiS2 +
3H2O → H2SiO3↓ + 2H2S↑
Растворимы в Н2О сульфиды щёлочных
и щелочноземельных металлов
2NaOH + H2S → Na2S + H2O
Нерастворимые
сульфиды можно получить взаимодействием соответствующей соли с Н2S
MnSO4 + H2S → MnS↓ + H2SO4 (CuS, PbS- чёрные ZnS –белый)
телесный
1. Есть сульфиды , которые можно перевести в растворимое состояние
действием кислот
FeS + 2HCl → FeCl2 + H2S
2. Которые нерастворимы в разбавленных кислотах, но реагируют с
окислителями
CuS + HNO3 → CuSO4 + NO2 +
H2O
3. Растворяются в растворах сульфидов
щелочных металлов
As2S3 +
3Na2S = 2Na3AsS3
H2S и сульфиды - сильные
восстановители.
4.Сплавление различных по природе сульфидов
Na2S + CS2 →
Na2CS3 –
тиокарбонат натрия
 H2S
хорошо растворим в спирте, несколько хуже в воде, придавая раствору слабокислый
характер. Водный раствор называется
сероводородной кислотой, двухосновна. H2S
хорошо растворим в спирте, несколько хуже в воде, придавая раствору слабокислый
характер. Водный раствор называется
сероводородной кислотой, двухосновна.
H2S ↔ H+ + HS- ↔ 2H+ + S-2 слабая кислота.
Образует
средние (сульфиды) и кислые (гидросульфиды) соли.
H2S
и сульфиды могут окислятся до S, SO2, SO42-
H2S + Br2 + H2O → H2SO4
+ HBr
H2S + H2SO4 → S + H2O
H2S + O2 → S + H2O
H2S
+ O2 → SO2 + H2O
H2S-2
+ I2 → HI- + S0
H2S
+ HNO3конц → S0↓
+ NO2 + H2O
| 
