Водородные
соединения азота
С водородом азот
образует два соединения: аммиак NH3 и гидразин N2H4 (H2N
– NH2). Наибольшее значение имеет аммиак.
В
лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом
натрия:
NH4Cl + NaOH = NaCl + NH3 + H2O
Основным
промышленным способом получения аммиака является синтез его из азота и водорода
N2 + 3H2 ↔ 2NH3 ∆ Н0 = - 82,4
(
Катализатор Pt; t = 450 - 5000С; Р = 250 атм)
Равновесие
обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с
резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3 поляризована – общие
электронные пары сдвинуты к азоту. Кроме того, у атома азота остается
неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает
многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель
ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования
водородных связей.
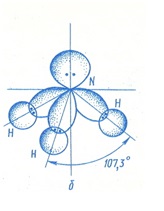
Расположение связей в
аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота
занимают одну из вершин тетраэдра.
Аммиак – очень
реакционно-способное вещество. Для него характерны реакции окисления и
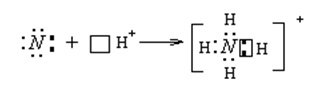
присоединения (благодаря неподеленной паре электронов). Наличие неподеленной
пары определяет основные свойства аммиака, который может присоединять протон,
образуя ион аммония NH4+.
NH3 очень хорошо
растворим в воде, но максимальная концентрация ω(NH3)= 25%. В растворе
имеют место равновесия:
NH3 + H2O ↔ NH3 • H2O
NH3 • H2O ↔ NH4OH
NH4OH ↔ NH4+ + OH–
Основная масса NH3 в растворе находится
в виде гидрата аммиака NH3 · H2O.
Поэтому, хотя NH4OH
диссоциирует почти нацело, его условно считают слабым основанием. Поскольку
азот в NH3 имеет низкую степень окисления –3, аммиак является восстановителем в ряде
реакций.
В
кислороде аммиак горит без катализатора:
4NH3 + 3O2 = 2N2 + 6 H2O,
а в присутствии катализатора платины
4NH3 + 5O2 = 4NO + 6H2O
При
нейтрализации раствора аммиака кислотами образуются растворы солей аммония,
содержащие ион NH4+.
NH3 + HCl = NH4Cl
NH3 + H2SO4 = (NH4)2SO4
В этих реакциях ион аммония подобен ионам
одновалентных металлов.
При замещении в молекуле аммиака 3-х атомов
водорода получаются нитриды, содержащую группу N-3
,
2-х атомов водорода – имиды NН-2 ,
одного атома водорода - амиды NН2-
.
2 NH3 + 6Na = 2Na3N
+3H2 нитрид натрия
NH3 +2Na = Na2HN + H2 имид натрия
2 NH3 +2Na = 2NaH2N + 3H2 амид натрия
NH3 всегда - восстановитель, окисляется до N2
или
NO.
t
CuO + NH3 → Cu +N2 +H2O
На этом свойстве основано применение NH3 и его солей в процессе
пайки металлов – снятие оксидной пленки с поверхности.
CuO + NH4Cl = Cu +N2 +HCl + H2O
CuO + NH4Cl = Cu + CuCl2 +H2O
Реагирует с более сильными
окислителями
NH3 + KMnO4 + H2SO4
→ N2 + MnSO4 + K2SO4 + H2O
Аммиак участвует в реакциях
комплексообразования, где NH3 является лигандом –
донором электронов.
CuSO4 +
4NH3 = [Cu(NH3)4]SO4
Hg(NO2)2 + 4NH3 =
[Hg(NH3)4](NO3)2
Водные растворы NH3 используют для
получения гидроксидов металлов.
Fe2(SO4)3 + NH3
+ H2O = Fe(OH)3↓ + (NH4)2SO4
Соли аммония все растворимы в воде,
разлагаются при температуре различным образом
(NH4)2Cr2O7
= Cr2O3 + N2 + 4H2O
NH4NO2 = N2 + 2H2O
NH4NO3 = NO + 2H2O
NH4Cl = NH3 + HCl
| 
