|
Азот (лат. nitrogenium)
в свободном состоянии газ без цвета и запаха. Азот – основной компонент
атмосферы Земли (78,09% по объему или 75,6% по массе, всего около 4·1015
т). Мы живем в азотной атмосфере, умеренно обогащенной кислородом и в малых
количествах другими химическими элементами.
В космосе он занимает
4-е место вслед за водородом, гелием и кислородом. В живых организмах его до
0,3% в виде соединений. Растения, получая азот из почвы в виде минеральных
солей, используют его для синтеза белков, витаминов и других жизненно важных
веществ.
Азот
относится к органогенам, наряду с углеродом, водородом и кислородом – элементы,
которые чаще всего содержатся в органических веществах. Все важнейшие части
клеток (протоплазма и ядро) построены из белковых веществ. Без белка нет жизни,
а без азота нет белка.
Свободный азот
несколько легче воздуха. Он плохо растворим в воде. Прочность молекулы азота
велика. Даже при 3300°С только одна из тысяч молекул N2 распадается на
атомы. Поэтому свободный азот в обычных условиях инертен к подавляющему
большинству веществ. Для того чтобы азот вступил в химическую реакцию,
требуется предварительная активация его молекул путем нагревания, облучения,
действие катализатора или другими способами.
Из металлов свободный
азот реагирует в обычных условиях только с литием, образуя нитрид:
6Li + N2 = 2Li3N
С Na,
Ca, Mg
реакция идет только при нагревании. С кислородом азот взаимодействует только в
электрической дуге (или при грозовом разряде в атмосфере):
N2 + O2 = 2NO
С водородом реакция
идет при нагревании (t ≈ 450-5000С),
под давлением и в присутствии катализатора
N2 + 3H2 = 2NH3
Пропуская азот через
раскаленный кокс можно получить (дициан)
– соединение азота с углеродом N ≡ C
— C ≡ N. С другими
неметаллами кроме бора свободный азот не реагирует.
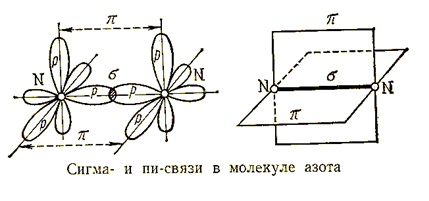
Причина инертности молекулярного азота –
крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются
одной σ - связью и двумя π- связями. Т.е.
связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы
затрачивается довольно большое количество энергии:
N2 = 2N ∆H0 = 946
кДж/моль
Строение молекулы N2
Получение N2
В промышленности –
сжижением воздуха с выделением фракций азота.
В лаборатории
разложением нитрита аммония или азида натрия
NH4NO2 = N2 + 2 H2O
2 NaN3 = 3 N2 + 2 Na
или 2NH3 + 3Br2 = N2
+ 6 HBr
|