|
2. Химия кислорода
По
электроотрицательности кислород уступает только фтору, степень окисления его в
большинстве соединений равна –2, но может проявить +2 и +4, а также +1 и –1 в
соединениях со связью –O-O-.
Подобно фтору образует соединения почти со всеми элементами (кроме гелия, неона
и аргона). Две аллотропные модификации: молекулярный кислород и озон. Наиболее
устойчива молекула О2. Однозначного решения в изображении
электронной структуры молекулы О2 еще не найдено.
Однако жидкий
кислород – обладает парамагнитными свойствами, втягивается в магнитное поле,
значит, у него есть неспареные электроны.
Для молекулярных
ионов:
О2+, О20, О2-, О2-2
N (кратность связи) 2,5 2 1,5 1
т.е.
положительный молекулярный ион О2+ - самый прочный
Лабораторные способы
получения О2
1.Термическое
разложение солей
2 KNO3 = 2 KNO2 + O2
2 KСlO3
= 2 KCl + 3 O2
2 KMnO4
= K2 MnO4 + MnO2 + O2
2BaO2 = 2BaO + O2
Промышленные
способы получения О2
1. Сжижение воздуха (tкип(O2)= -183oC), tкип(N2)= - 196oC)
2.Электролизом
водных растворов щелочей, который сводится
к электролизу H2O
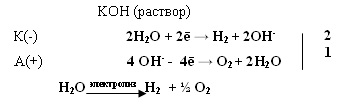
Химические свойства О2
1.Плохо растворим в воде
2. Реагирует с большинством
металлов и неметаллов
2Са + О2 = 2СаО
О2 + N2 =
2 NO (t ≈ 3000oC,
разряд молнии)
4P +
O2 = 2P2O5
H2S
+ O2 = SO2 + H2O
2ZnS + 3O2 = 2ZnO + 2SO2
CH4 + O2 = CO2 + H2O
K + O2 = K[O2]- -
надпероксид калия
2Na + O2 = Na2O2 - пероксид натрия
| 
